Apakah Atom Itu?
Pengertian Atom yaitu partikel terkecil suatu zat yang tidak sanggup dipecah lagi atau dibagi-bagi lagi. Kata atom berasal dari kata Yunani atomos, artinya tidak sanggup dibagi-bagi lagi. Teori ihwal atom pertama kali dikemukakan oleh hebat filsafat Yunani, Leukippos (Leucippus) dan Demokritus (Democritus) pada kala ke-4 sebelum Masehi (400-370) SM). Pada masa itu terdapat pendapat lain dikemukakan filsuf terkenal, Aristoteles (384-332 SM) bahwa materi sanggup dibagi terus-menerus tanpa batas. Namun kemudian pada kala ke-18 banyak hebat kimia lebih mendapatkan pendapat Leukippos dan Demokritus daripada teori Aristoteles.
Teori-teori Atom
Teori Atom Dalton
Pada tahun 1803, John Dalton (1766-1844), seorang guru sekolah dari Inggris, spesialis dalam bidang fisika dan kimia mengajukan pendapat bahwa materi terdiri atas atom-atom. Postulat yang dikemukakan D alton sanggup disimpulkan sebagai berikut.
a. Atom merupakan bab terkecil materi, tidak sanggup dibagi-bagi lagi dengan reaksi kimia biasa.
b. Atom digambarkan sebagai bola pejal yang sangat kecil. Suatu unsur mempunyai atom-atom yang identik dan berbeda dengan unsur lain.
c. Atom tidak sanggup dipecah menjadi partikel yang lebih kecil dengan sifat yang sama.
d. Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bundar dan sederhana. Misalnya air terdiri atas atom-atom hidrogen dan atom-atom oksigen.
e. Reaksi kimia merupakan pemisahan, penggabungan, atau penyusunan kembali dari atom-atom, sehingga atom tidak sanggup diciptakan atau dimusnahkan.
Postulat Dalton menggambarkan bahwa atom merupakan bola pejal menyerupai bola tolak peluru yang sangat kecil.
Teori Atom Thomson
Pada percobaan Golstein timbul pertanyaan darimana asal dan bagaimana cara terbentuknya sinar positif. Thomson menduga sinar itu dari atom gas dalam tabung. Percobaan menawarkan bahwa setiap atom mengandung elektron. Jika atom kehilangan elektron bermuatan negatif, tentu yang tinggal bermuatan positif. Jumlah muatan positif yang tinggal tentu sama dengan jumlah muatan elektron yang keluar, alasannya yaitu pada mulanya atom itu netral. Elektron sangat ringan sehingga sanggup meninggalkan atom jikalau diberi energi. Akhirnya Thomson (1898) merumuskan teori yang disebut teori atom Thomson.
Bunyi teori atom Thomson: "Atom merupakan sebuah bola kecil yang bermuatan positif dan di permukaannya tersebar elektron yang bermuatan negatif."
Model atau teori atom ini juga disebut model roti kismis, alasannya yaitu menyerupai dengan roti yang ditaburi kismis di permukaannya. Teori atom Thomson sanggup digunakan untuk menjelaskan cara terbentuknya sinar positif dalam tabung Golstein.
Teori Atom Rutherford
Ernest Rutherford dan temannya melaksanakan percobaan yaitu melewatkan sinar alfa dalam tabung berisi gas. Ternyata sinar bergerak lurus tanpa dipengaruhi oleh gas. Mereka menduga bahwa molekul gas tidak bermuatan dan mengubah arah sinar alfa yang bermuatan positif. Berdasarkan ini, Rutherford beropini bahwa partikel alfa dalam padatan akan merubah arah, alasannya yaitu dalam atom terdapat muatan positif.
Hipotesis ini pada tahun 1909 dibuktikan dengan percobaan oleh Geiger dan Marsden. Mereka menembakkan sinar alfa pada selempeng platina tipis setebal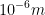 . Hasil menawarkan bahwa sinar alfa yang ditembakkan ada yang tembus, membelok dan memantul. Berdasarkan hal ini maka Rutherford menyimpulkan bahwa:
. Hasil menawarkan bahwa sinar alfa yang ditembakkan ada yang tembus, membelok dan memantul. Berdasarkan hal ini maka Rutherford menyimpulkan bahwa:
"Atom terdiri atas inti yang bermuatan positif yang merupakan sentra massa. Di sekitar inti terdapat elektron yang bergerak mengelilinginya dalam ruang hampa."
Teori Atom Bohr
Pada tahun 1808 John Dalton dengan teori atom Dalton mengemukakan bahwa semua zat tersusun dari partikel-partikel kecil disebut atom. Atom itu tidak sanggup dibagi, diciptakan dan dimusknahkan. Namun hasil percobaan menemukan bahwa ada partikel yang lebih kecil atau partikel subatomik, yaitu proton dan neutron yang tersusun disekitar inti, Selanjutnya pada tahun 1913 Neils Bohr menerangkan hal penting yang berkaitan dengan sifat atom dalam postulat sebagai berikut.
a. Elektron mengelilingi inti atom pada orbit tertentu. Orbit itu merupakan lintasan gerak stasioner elektron mengelilingi inti dan berjarak terterntu dari inti. Lintasan yang digunakan elektron diberi nomor 1, 2, 3, .... Bilangn yang menyatakan lintasan elektron disebut kulit atom.
b. Selama berada dalam lintasannya, energi elektron tetap sehingga tidak ada energi yang di serap?dipancarkan.
c. Elektron hanya sanggup pindah dari satu lintasan stasioner ke lintasan stasioner lainnya jikalau menyerap/memancarkan energi sebesar persamaan Plancik, yaitu AE = h . V
d. Lintasan stasioner elektron yang diperbolehkan mempunyai besar momentum sudut kelipatan dari h/2p.
Struktur Atom
Elektron
Pengertian elektron adalah partikel subatomik bermuatan negatif yang melekat pada inti atom.
Elektron ditemukan oleh Joseph John Thomson pada tahun 1900. Dasar inovasi elektron ini yaitu percobaan yang dilakukan Sir Humphry Davy pada tahun 1821 dari Inggris, yang populer dengan percobaan hantaran listrik melalui tabung hampa.
Sinar Katoda merupakan sinar paling ringan dan paling kecil. Sinar Katoda tidak bergantung pada materi katoda yang digunakan. Hal ini dibuktikan oleh Thomson. Partikel pada sinar katoda ini disebut elektron. Sifat sinar katoda antara lain:
a. Sinar katoda bergerak lurus
b. Sinar inti sanggup memutar baling baling.
c. Sinar katoda dibelokkan oleh medan listrik dan magnet.
d. Muatan partikelnya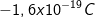
Percobaan tersebut mencapai puncaknya sesudah Thomson sanggup menghitung perbandingan muatan terhadap massa dari sinar katoda sebesar . Thomson berkesimpulan baha sinar atau partikel tersebut yaitu elektron yang merupakan bab dari katoda yang terdiri atas atom-atom.
. Thomson berkesimpulan baha sinar atau partikel tersebut yaitu elektron yang merupakan bab dari katoda yang terdiri atas atom-atom.
Jumlah elektron dalam suatu atom merupakan nomor atom suatu atom dan untuk notasinya nomor atom biasanya ditulis di bab kiri bawah dari lambang atom, contohnya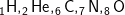 . Nomor-nomor tersebut menyatakan muatan pada dasarnya atau jumlah proton dalam intinya.
. Nomor-nomor tersebut menyatakan muatan pada dasarnya atau jumlah proton dalam intinya.
Jumlah muatan positif pada inti atom sama dengan jumlah muatan negatif pada elektron, sehingga jumlah inti atom (proton) sama dengan jumlah elektron. Maka nomor atom suatu unsur selain menawarkan jumlah proton juga menawarkan jumlah elektron.
Proton
Pengertian proton yaitu partikel subatomik bermuatan positif yang melekat pada inti atom.
Golstein pada tahun 1886 menciptakan alat yang menyerupai tabung Crookes. Katoda dibentuk berlubang dan diletakkan agak ke dalam. Tabung diisi gas hidrogen bertekanan rendah. Setelah dialirkan listrik menghasilkan dua macam sinar, yaitu sinar katoda yang bergerak dari katoda ke anoda, dan sinar yang bergerak ke katoda dan sebagian masuk ke dalam lubang sehingga disebut sinar saluran. Sinar jalan masuk ini bermuatan positif, alasannya yaitu itu disebut sinar positif. Sinar positif ini kemudian disebut proton. Massa proton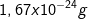 (1.836 x massa elektron).
(1.836 x massa elektron).
Neutron
Pengertian neutron yaitu partikel subatomik tidak bermuatan positif maupun negaitf yang melekat pada inti atom.
Selain elektron dan proton ada partikel lain, yaitu neutron. Neutron bermassa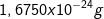 dan tidak bermuatan alias netral. Neutron ditemukan James Chadwick pada tahun 1932. Chadwick membuktikan melalui percobaan menembak partikel alfa pada lempengan berilium.
dan tidak bermuatan alias netral. Neutron ditemukan James Chadwick pada tahun 1932. Chadwick membuktikan melalui percobaan menembak partikel alfa pada lempengan berilium.
Inti Atom (Nucleus)
Inti atom adalah bab dari atom yang mempunyai nilai positif. Inti atom merupakan kumpulan dari dua jenis nukelon (partikel penyusun inti), yaitu proton bermuatan positif serta nutron tidak bermuatan (netral). Sebenarnya inti atom tersusun dari banyak partikel materi, tetapi yang paling berperan yaitu proton dan neutron.
Elektron Valensi
Pengertian elektron valensi yaitu jumlah elektron pada kulit paling luar suatu atom unsur. Cara memilih elektron valensi dengan cara menuliskan konfigurasi elektron, kemudian jumlah elektron pada kulit paling luar merupakan elektron valensi.
Konfigurasi Elektron
Unsur-unsur dalam sistem periodik disusun menurut nomor atom. Nomor atom menawarkan jumlah proton dalam inti atom serta jumlah elektron dalam atom. Persebaran elektron dalam kulit-kulit atom dinamakan konfigurasi elektron, dengan hukum sebagai berikut.
a. Tiap kulit atom dari paling dalam diberi notasi K, L, M, N, .... menyatakan kulit atom 1, 2, 3, 4, ....
b. Tiap kulit atom meaksimum berisi elektron, dimana n yaitu nomor kulit atom.
elektron, dimana n yaitu nomor kulit atom.
Atom-atom unsur mempunyai elektron valensi yang sama dimungkinkan mempunyai sifat-sifat yang hampir sama pula. Sehingga dalam sistem bersiklus unsur, atom-atom unsur yang mempunyai elektron valensi sama,juga terdapat dalam golongan yang sama.
Nomor Atom dan Nomor Massa
Nomor Atom
Semua atom sanggup diidentifikasi menurut jumlah kandungan proton dan neutronnya. Jumlah proton dalam inti atom suatu unsur disebut nomor atom, dilambangkan dengan Z. Dalam suatu atom netral jumlah proton sama dengan jumlah elektron, sehingga nomor atom juga menerangkan jumlah elektron dalam atom. Nomor atom ditulis agak ke bawah sebelum lambang unsur.
Contoh: Atom oksigen mempunyai 8 proton dan 8 elektron, sehingga nomor atom oksigen yaitu 8.
Nomor Massa
Nomor massa yaitu jumlah total neutron dan proton dalam atom suatu unsur.
Nomor massa = jumlah proton + jumlah neutron
Nomor massa = nomor atom + jumlah nutron
Jumlah proton suatu atom sama dengan selisih antara nomor massa dan nomor atom. Penulisan lambang atom unsur menyertakan nomor atom dan nomor massa sebagai berikut.
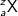
Keterangan:
X = lambang atom
A = nomor massa
Z = nomor atom
Contoh: Atom 11 12Na menawarkan bahwa atom nutrium mempunyai atom = 11 dan nomor massa = 23
Massa Atom Relatif
Bagaimana cara mengetahui massa atom dari suatu unsur? Untuk mengetahui massa atom dari unsur, maka digunakan perbandingan dengan massa atom standart, yaitu atom karbon -12 (C-12). Massa atom relatif (Ar) dari suatu unsur yaitu massa atom unsur tersebut relatif terhadap 1/12 massa atom karbon C-12. Atom C-12 digunakan sebagai standart alasannya yaitu atom C-12 termasuk unsur yang umum dan gampang didapat. Selain itu menghasilkan nilai massa atom relatif unsur mendekati bilangan bulat.
Isotop
Isotop yaitu atom-atom yang mempunyai nomor atom sama, tetapi berbeda nomor massanya
Isobar
Isobar yaitu atom dari unsur berbeda (mempunyai nomor atom berbeda), tetapi mempunyai nomor massa sama.
Isoton
Isoton yaitu atom dari unsur berbeda (mempunyai nomor atom berbeda), tetapi mempunyai jumlah neutron sama.
Teori-teori Atom
Teori Atom Dalton
Pada tahun 1803, John Dalton (1766-1844), seorang guru sekolah dari Inggris, spesialis dalam bidang fisika dan kimia mengajukan pendapat bahwa materi terdiri atas atom-atom. Postulat yang dikemukakan D alton sanggup disimpulkan sebagai berikut.
a. Atom merupakan bab terkecil materi, tidak sanggup dibagi-bagi lagi dengan reaksi kimia biasa.
b. Atom digambarkan sebagai bola pejal yang sangat kecil. Suatu unsur mempunyai atom-atom yang identik dan berbeda dengan unsur lain.
c. Atom tidak sanggup dipecah menjadi partikel yang lebih kecil dengan sifat yang sama.
d. Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bundar dan sederhana. Misalnya air terdiri atas atom-atom hidrogen dan atom-atom oksigen.
e. Reaksi kimia merupakan pemisahan, penggabungan, atau penyusunan kembali dari atom-atom, sehingga atom tidak sanggup diciptakan atau dimusnahkan.
Postulat Dalton menggambarkan bahwa atom merupakan bola pejal menyerupai bola tolak peluru yang sangat kecil.
Teori Atom Thomson
Pada percobaan Golstein timbul pertanyaan darimana asal dan bagaimana cara terbentuknya sinar positif. Thomson menduga sinar itu dari atom gas dalam tabung. Percobaan menawarkan bahwa setiap atom mengandung elektron. Jika atom kehilangan elektron bermuatan negatif, tentu yang tinggal bermuatan positif. Jumlah muatan positif yang tinggal tentu sama dengan jumlah muatan elektron yang keluar, alasannya yaitu pada mulanya atom itu netral. Elektron sangat ringan sehingga sanggup meninggalkan atom jikalau diberi energi. Akhirnya Thomson (1898) merumuskan teori yang disebut teori atom Thomson.
Bunyi teori atom Thomson: "Atom merupakan sebuah bola kecil yang bermuatan positif dan di permukaannya tersebar elektron yang bermuatan negatif."
Model atau teori atom ini juga disebut model roti kismis, alasannya yaitu menyerupai dengan roti yang ditaburi kismis di permukaannya. Teori atom Thomson sanggup digunakan untuk menjelaskan cara terbentuknya sinar positif dalam tabung Golstein.
Teori Atom Rutherford
Ernest Rutherford dan temannya melaksanakan percobaan yaitu melewatkan sinar alfa dalam tabung berisi gas. Ternyata sinar bergerak lurus tanpa dipengaruhi oleh gas. Mereka menduga bahwa molekul gas tidak bermuatan dan mengubah arah sinar alfa yang bermuatan positif. Berdasarkan ini, Rutherford beropini bahwa partikel alfa dalam padatan akan merubah arah, alasannya yaitu dalam atom terdapat muatan positif.
Hipotesis ini pada tahun 1909 dibuktikan dengan percobaan oleh Geiger dan Marsden. Mereka menembakkan sinar alfa pada selempeng platina tipis setebal
"Atom terdiri atas inti yang bermuatan positif yang merupakan sentra massa. Di sekitar inti terdapat elektron yang bergerak mengelilinginya dalam ruang hampa."
Teori Atom Bohr
Pada tahun 1808 John Dalton dengan teori atom Dalton mengemukakan bahwa semua zat tersusun dari partikel-partikel kecil disebut atom. Atom itu tidak sanggup dibagi, diciptakan dan dimusknahkan. Namun hasil percobaan menemukan bahwa ada partikel yang lebih kecil atau partikel subatomik, yaitu proton dan neutron yang tersusun disekitar inti, Selanjutnya pada tahun 1913 Neils Bohr menerangkan hal penting yang berkaitan dengan sifat atom dalam postulat sebagai berikut.
a. Elektron mengelilingi inti atom pada orbit tertentu. Orbit itu merupakan lintasan gerak stasioner elektron mengelilingi inti dan berjarak terterntu dari inti. Lintasan yang digunakan elektron diberi nomor 1, 2, 3, .... Bilangn yang menyatakan lintasan elektron disebut kulit atom.
b. Selama berada dalam lintasannya, energi elektron tetap sehingga tidak ada energi yang di serap?dipancarkan.
c. Elektron hanya sanggup pindah dari satu lintasan stasioner ke lintasan stasioner lainnya jikalau menyerap/memancarkan energi sebesar persamaan Plancik, yaitu AE = h . V
d. Lintasan stasioner elektron yang diperbolehkan mempunyai besar momentum sudut kelipatan dari h/2p.
Struktur Atom
Elektron
Pengertian elektron adalah partikel subatomik bermuatan negatif yang melekat pada inti atom.
Elektron ditemukan oleh Joseph John Thomson pada tahun 1900. Dasar inovasi elektron ini yaitu percobaan yang dilakukan Sir Humphry Davy pada tahun 1821 dari Inggris, yang populer dengan percobaan hantaran listrik melalui tabung hampa.
Sinar Katoda merupakan sinar paling ringan dan paling kecil. Sinar Katoda tidak bergantung pada materi katoda yang digunakan. Hal ini dibuktikan oleh Thomson. Partikel pada sinar katoda ini disebut elektron. Sifat sinar katoda antara lain:
a. Sinar katoda bergerak lurus
b. Sinar inti sanggup memutar baling baling.
c. Sinar katoda dibelokkan oleh medan listrik dan magnet.
d. Muatan partikelnya
Percobaan tersebut mencapai puncaknya sesudah Thomson sanggup menghitung perbandingan muatan terhadap massa dari sinar katoda sebesar
Jumlah elektron dalam suatu atom merupakan nomor atom suatu atom dan untuk notasinya nomor atom biasanya ditulis di bab kiri bawah dari lambang atom, contohnya
Jumlah muatan positif pada inti atom sama dengan jumlah muatan negatif pada elektron, sehingga jumlah inti atom (proton) sama dengan jumlah elektron. Maka nomor atom suatu unsur selain menawarkan jumlah proton juga menawarkan jumlah elektron.
Proton
Pengertian proton yaitu partikel subatomik bermuatan positif yang melekat pada inti atom.
Golstein pada tahun 1886 menciptakan alat yang menyerupai tabung Crookes. Katoda dibentuk berlubang dan diletakkan agak ke dalam. Tabung diisi gas hidrogen bertekanan rendah. Setelah dialirkan listrik menghasilkan dua macam sinar, yaitu sinar katoda yang bergerak dari katoda ke anoda, dan sinar yang bergerak ke katoda dan sebagian masuk ke dalam lubang sehingga disebut sinar saluran. Sinar jalan masuk ini bermuatan positif, alasannya yaitu itu disebut sinar positif. Sinar positif ini kemudian disebut proton. Massa proton
Neutron
Pengertian neutron yaitu partikel subatomik tidak bermuatan positif maupun negaitf yang melekat pada inti atom.
Selain elektron dan proton ada partikel lain, yaitu neutron. Neutron bermassa
Inti Atom (Nucleus)
Inti atom adalah bab dari atom yang mempunyai nilai positif. Inti atom merupakan kumpulan dari dua jenis nukelon (partikel penyusun inti), yaitu proton bermuatan positif serta nutron tidak bermuatan (netral). Sebenarnya inti atom tersusun dari banyak partikel materi, tetapi yang paling berperan yaitu proton dan neutron.
Elektron Valensi
Pengertian elektron valensi yaitu jumlah elektron pada kulit paling luar suatu atom unsur. Cara memilih elektron valensi dengan cara menuliskan konfigurasi elektron, kemudian jumlah elektron pada kulit paling luar merupakan elektron valensi.
Konfigurasi Elektron
Unsur-unsur dalam sistem periodik disusun menurut nomor atom. Nomor atom menawarkan jumlah proton dalam inti atom serta jumlah elektron dalam atom. Persebaran elektron dalam kulit-kulit atom dinamakan konfigurasi elektron, dengan hukum sebagai berikut.
a. Tiap kulit atom dari paling dalam diberi notasi K, L, M, N, .... menyatakan kulit atom 1, 2, 3, 4, ....
b. Tiap kulit atom meaksimum berisi
Atom-atom unsur mempunyai elektron valensi yang sama dimungkinkan mempunyai sifat-sifat yang hampir sama pula. Sehingga dalam sistem bersiklus unsur, atom-atom unsur yang mempunyai elektron valensi sama,juga terdapat dalam golongan yang sama.
Nomor Atom dan Nomor Massa
Nomor Atom
Semua atom sanggup diidentifikasi menurut jumlah kandungan proton dan neutronnya. Jumlah proton dalam inti atom suatu unsur disebut nomor atom, dilambangkan dengan Z. Dalam suatu atom netral jumlah proton sama dengan jumlah elektron, sehingga nomor atom juga menerangkan jumlah elektron dalam atom. Nomor atom ditulis agak ke bawah sebelum lambang unsur.
Contoh: Atom oksigen mempunyai 8 proton dan 8 elektron, sehingga nomor atom oksigen yaitu 8.
Nomor Massa
Nomor massa yaitu jumlah total neutron dan proton dalam atom suatu unsur.
Nomor massa = jumlah proton + jumlah neutron
Nomor massa = nomor atom + jumlah nutron
Jumlah proton suatu atom sama dengan selisih antara nomor massa dan nomor atom. Penulisan lambang atom unsur menyertakan nomor atom dan nomor massa sebagai berikut.
Keterangan:
X = lambang atom
A = nomor massa
Z = nomor atom
Contoh: Atom 11 12Na menawarkan bahwa atom nutrium mempunyai atom = 11 dan nomor massa = 23
Massa Atom Relatif
Bagaimana cara mengetahui massa atom dari suatu unsur? Untuk mengetahui massa atom dari unsur, maka digunakan perbandingan dengan massa atom standart, yaitu atom karbon -12 (C-12). Massa atom relatif (Ar) dari suatu unsur yaitu massa atom unsur tersebut relatif terhadap 1/12 massa atom karbon C-12. Atom C-12 digunakan sebagai standart alasannya yaitu atom C-12 termasuk unsur yang umum dan gampang didapat. Selain itu menghasilkan nilai massa atom relatif unsur mendekati bilangan bulat.
Isotop
Isotop yaitu atom-atom yang mempunyai nomor atom sama, tetapi berbeda nomor massanya
Isobar
Isobar yaitu atom dari unsur berbeda (mempunyai nomor atom berbeda), tetapi mempunyai nomor massa sama.
Isoton
Isoton yaitu atom dari unsur berbeda (mempunyai nomor atom berbeda), tetapi mempunyai jumlah neutron sama.

